Исследования
Анализ экспрессии ключевых белков-регуляторов апоптоза и аутофагии в патогенезе иммунного и аутоиммунного ответа. Связь возникновения аутоиммунного ответа у больных бронхиальной астмой и системной красной волчанкой с нарушением LC3-ассоциированного фагоцитоза
Исполнители: с.н.с., к.б.н. Скибо Ю.В., м.н.с. Абрамов С.Н., лаб.-исследователь, б/с Тихомирова М.В., с.н.с., к.б.н. Биктагирова Э.М., профессор, д.б.н. Абрамова З.И.
Гипотеза: при наличии аберрантных клеток, которые могут стать онкологическими, а также клеток, инфицированных различными патогенами, происходит активация Т-лимфоцитов. Под влиянием различных факторов активированные Т-клетки могут быть направлены против собственных клеток организма, что приводит к аллергическим и аутоиммунным заболеваниям, таким как астма, рассеянный склероз, системная красная волчанка. Одним из подобных факторов может стать нарушение в реализации программы клеточной гибели, которая представлена несколькими типами. И в рамках данного проекта рассматриваются основные ее типы как апоптоз, аутофагия и LC3-ассоциированный фагоцитоз, на примере бронхиальной астмы (БА) и системной красной волчанки (СКВ).
Задачи:
- Оценить основные показатели аутофагии в Т-лимфоцитах больных БА и СКВ;
- Определить уровень экспрессии генов Rubicon, Beclin-1, UVRAG, VPS34, ответственных за формирование LAPосомы в Т-лимфоцитах больных БА и СКВ;
- Охарактеризовать основные морфо-биохимические показатели апоптоза в Т-лимфоцитах больных БА и СКВ;
- Провести корреляционный анализ полученных данных и описать возможные механизмы, приводящие к аутоиммунной отягощенности.
Результаты: установлено слабое проявление апоптоза Т-лимфоцитов у больных бронхиальной астмой in vitro. Также в Т-клетках больных астмой показана активация аутофагии: в группе с легкой формой заболевания аутофагия приводит к гибели Т-лимфоцитов по пути программированной клеточной гибели II типа. В группе с тяжелой формой астмы аутофагия способствует устойчивости клеток к гибели и их длительному функционированию. Мы обнаружили слабое проявление LC3-ассоциированного фагоцитоза, что вместе с торможением апоптоза на заключительных стадиях может являться причиной появления аутоантигенов и развития аутоиммунного ответа. Помимо ультраструктурных, существуют молекулярные изменения, которые обуславливают тип аутофагии (канонический или LAP), изучение которых и станет целью дальнейших исследований.
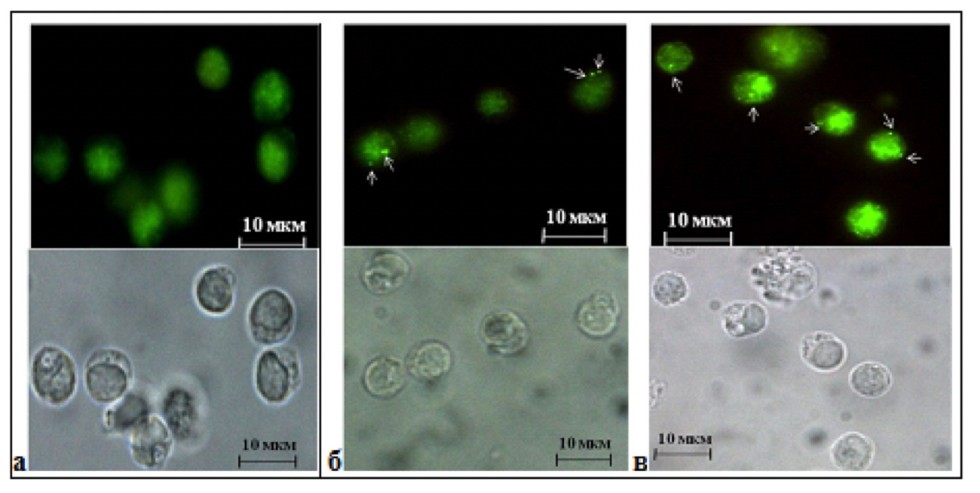
| Рис. 1. Репрезентативные микрофотографии Т-лимфоцитов здорового донора и больных легкой и тяжелой формами бронхиальной астмы после 3 дней культивирования. (а) Установлено отсутствие экспрессии LC3B белка в Т-лимфоцитах здорового донора; (б) Экспрессия LC3B белка на аутофагасомах в Т-лимфоцитах больных легкой формой астмы; (в) Экспрессия LC3B белка на аутофагасомах в Т-лимфоцитах больных тяжелой формой АБА. |
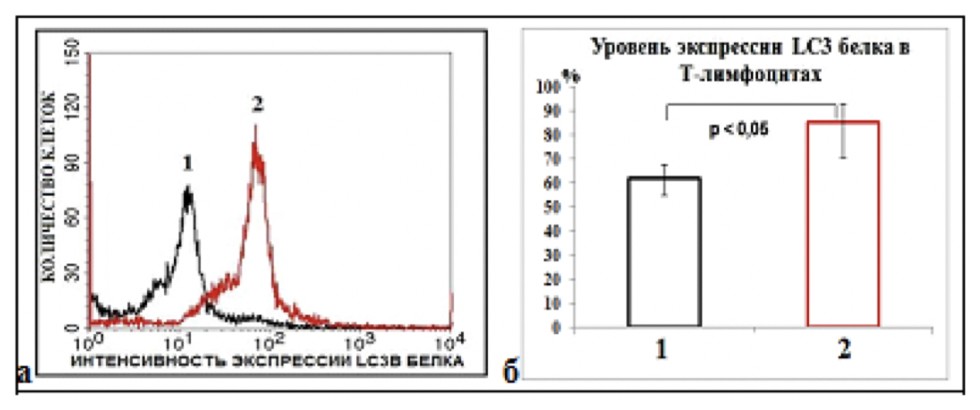
| Рис. 2. Количественная оценка и интенсивность экспрессии LC3Bбелка в Т-лимфоцитах больных легкой (1) и тяжелой (2) формами астмы |
Поддержано грантом РФФИ мол-А № 18-34-00739.
Влияние риск аллели А полиморфизма rs200395694 на регуляцию гена MEF2D и альтернативный сплайсинг у больных СКВ
Исполнители: Абрамов С.Н, Козырев С.В.
Системная красная волчанка (СКВ) – одно из наиболее тяжелых аутоиммунных заболеваний человека. Заболеваемость СКВ у женщин до 10 раз выше, чем у мужчин. С этнической принадлежностью связаны распространенность, течение заболевания и смертность. Эти факты говорят о том, что генетическая предрасположенность может играть важную роль в появлении и развитии СКВ. Мы использовали метод секвенирования нового поколения, для поиска новых полиморфизмов, которые могут играть роль в наследуемости заболевания. После анализа данных мы обнаружили новый полиморфизм rs200395694 расположенный в гене MEF2D кодирующем транскрипционный фактор MEF2D, ассоциированный с СКВ у шведов. Регуляторный потенциал rs200395694 был исследован с помощью EMSA и люциферазного репортерного анализа и показал аллельные различия как в связывании белок-ДНК, так и в репортерной транскрипции.
Сплайсинг гена MEF2D изучали методом ПЦР и qRT-PCR с использованием РНК, выделенной из РВМС и различных клеточных линий.
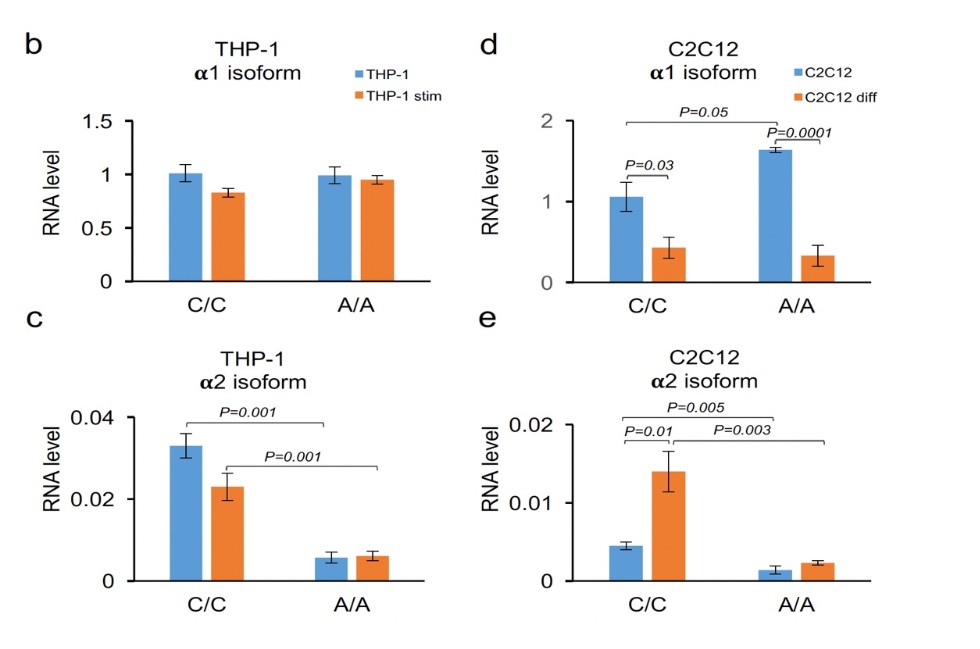
Две основные изоформы a1 и a2 были обнаружены в PBMC, THP-1, K562 и Daudi, но только транскрипт a1 был обнаружен в линии T-клеток Jurkat, HeLa и HEK293. Использовались минигены с разными генотипами, чтобы оценить влияние полиморфизма на сплайсинг. Не было различий между аллелями для изоформы a1 ни в одной из проанализированных клеточных линий, в то время как изоформа a2 была значительно подавлена редким аллелем A.
Вывод: мы идентифицировали связь регуляторного варианта rs200395694 с СКВ у шведских пациентов. Аллель риска оказывает влияние на регуляцию генов, а также ингибирует сплайсинг альтернативного транскрипта MEF2D
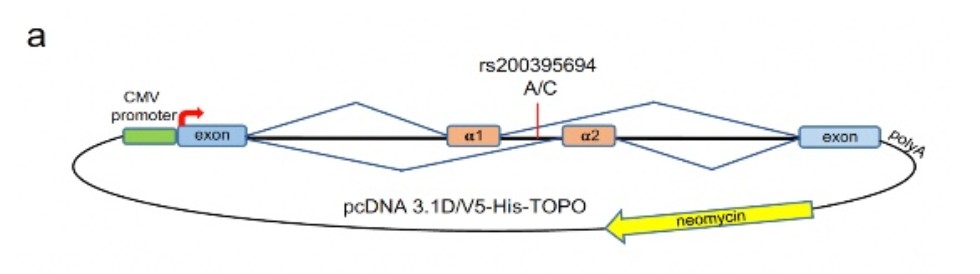
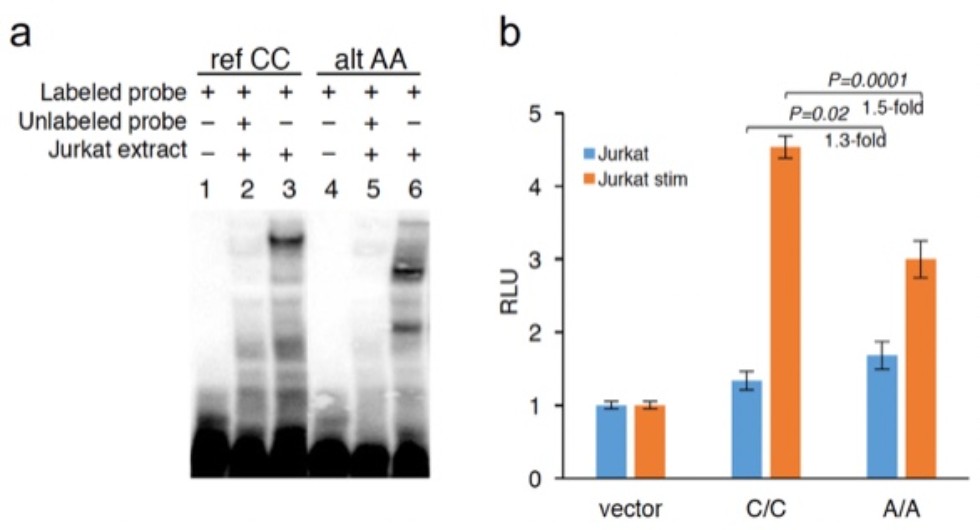
| Анализ альтернативного сплайсинга при помощи минигенных конструкций. (а) Структура минигенов с альтернативным аллелем клонированным в вектор pcDNA3.1 между промотором CMV и сайтом полиаделирования. (b-e) Уровни РНК альтернативных изоформ транскрибируемых из минигенов в клетках THP-1 клетках (b,c) и C2C12 клетках (d,e) измереные при помощи количественного RT-PCR. Клетки THP-1 были стимулированы LPS (С=100 ng/ml) интерероном-гамма (С= 10 ng/ml) в течении 12 часов. Стимуляция C2C12 была выполнена в течении 3х дней при помощи 2% лошадиной сыворотки. Столбцы отражают средние значения +/- cтандартная ошибка среднего. |
| EMSA и регуляторный потенциал алелей полиморфизма rs200395694. (a) результаты EMSA с ядерным экстрактом из клеточной линии Jurkat. (b) Люциферазный анализ на клеточной линии Jurkat. Столбцы обозначают срение значения +/- стандартное отклонение, относительных световых единиц. Стат. Анализ выполнен при помощи непарного t теста. |
Исследование новых эффективных противоопухолевых лекарственных трополонсодержащих субстанций и моделирования их активности
Исполнители: Денека А., Мазитова А., Топчу Ю, Бумбер Я., Биктагирова Э., Давлетшин Д., Хусаинова Э.
В рамках сотрудничества с ЮНЦ РАН проводится исследование цитотоксичности трополонсодержащих субстанций на опухолевых клеточных линиях.
Трополонсодержащие субстанции предоставлены сотрудниками лаборатории физической органической химии ЮНЦ РАН Ю.А. Саяпиным и Гусаковым Е.А. исследование цитотоксичности ведется внутри НИЛ "Молекулярные основы терапии и патогенеза опухолевых заболеваний".
Общая цитотоксичность характеризуется одинаковой чувствительностью к действию вещества независимо от типа клеток.
| Исследование жизнеспособности клеток выполняется с использованием реагента Alamar Blue. Метод оценки жизнеспособности клеток основан на преобразовании нетоксичного водорастворимого резазурина во флуоресцентное вещество резоруфин. |
Сотрудниками подана заявка на совместный грант РНФ, в случае поддержки планируется провести серию опытов на исследование токсичности на мышиных моделях.
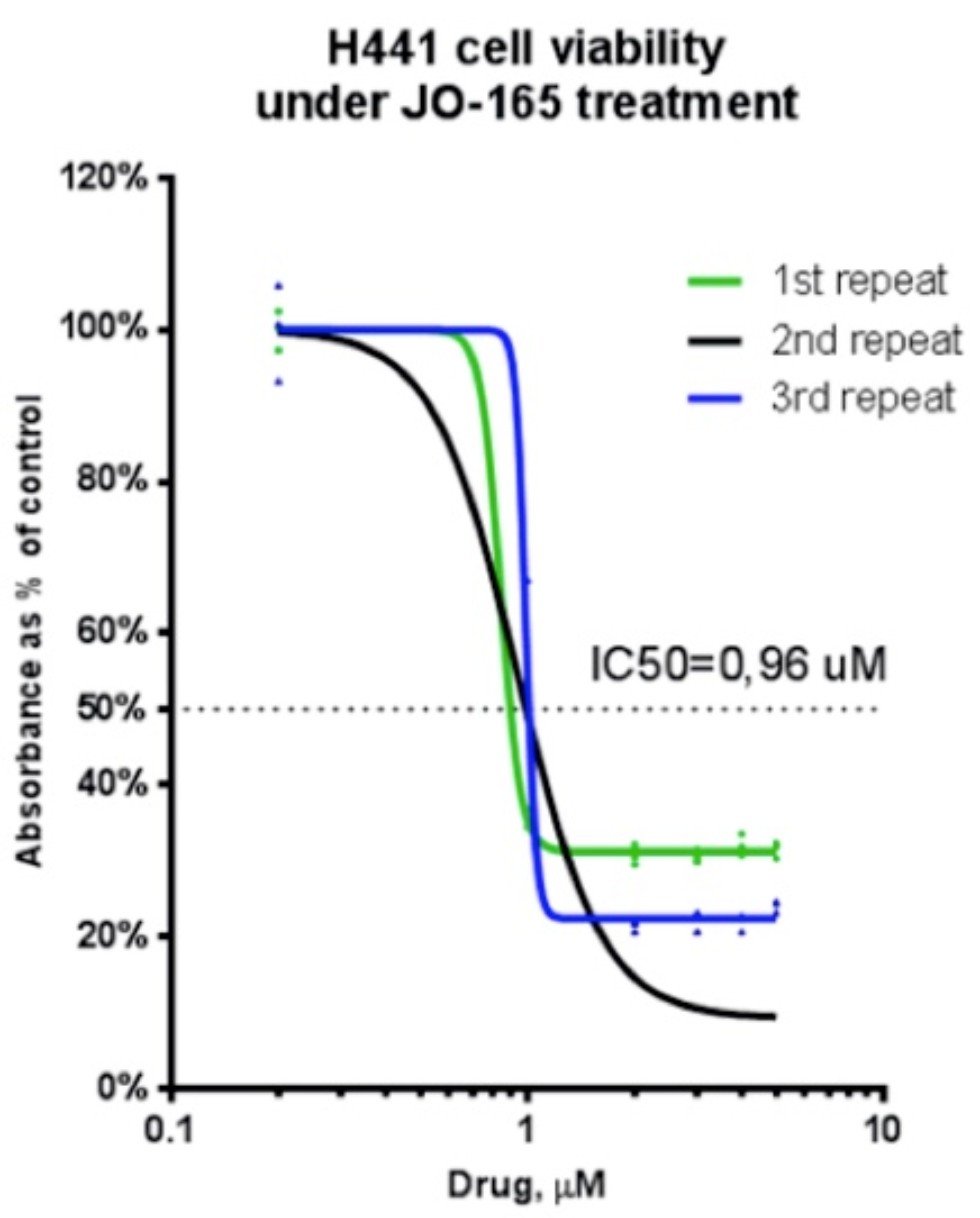
| Влияние соединения JO-165 на жизнеспособность клеток H441. Клетки с начальной плотностью 0,15 × 10⁴ на лунку обрабатывали соединением JO-165 в конечном объеме 100 мклполной среды RPMI-1640, содержащей 10% FCS, в течение 72 часов. Данные представлены в виде среднего значения и SEM (столбцы ошибок) для n = 3 |
Исследование роли белка Мусаши 2 в регулировании сигнального пути VEGFR2-VEGFA и смежных белков-мишеней при раке легкого
Исполнители: Бумбер Я., Денека А., Топчу Ю., Мазитова A.
С использованием метастатических мышиных и человеческих клеточных линий немелкоклеточного рака легкого, а также при сравнении клеточных линий НМРЛ с высоким и низким метастатическим потенциалом, полученных из опухолей трансгенных KrasLA1/+/р53R172HDG/+ мышей обнаружено, что одной из наиболее постоянных фенотипических особенностей метастазирующих клеток являлось повышение уровня белка Musashi-2 (MSI2), который играет важную роль при инвазии и метастазировании НМРЛ in vitro и in vivo. Ранее проведенный анализ предполагаемого сигнального пути и скрининг релевантных мишеней MSI2 выявил ряд белков, ассоциированных с эпителиально-мезенхимальным переходом (ЭМП) - рецептор TGF-β (TGFBRI) I типа, SMAD3, клаудины, а также рецептор фактора роста эндотелия сосудов (VEGFR2).
Три основные фундаментальные задачи представляют значительный научный интерес в планируемом исследовании:
- Изучить роль белка Мусаши 2 в регулировании сигнального пути VEGFR2-VEGFA и смежных белков-мишеней при раке легкого (Нами впервые была показана регуляция пути VEGFR2-VEGFA Мусаши 2).
- Oпределить роль взаимодействия белка Мусаши 2 и пути VEGFR2-VEGFA в контексте таргетной терапии, воздействующей на эти белки и MSI2 (роль MSI2 в регуляции ответа на воздействие ингибиторами VEGF/VEGFR2 кабозантинибом и пазопанибом).
- Выявить белки-партнеры, взаимодействующие с Мусаши-2 и критически важные для роста и развития НМРЛ.
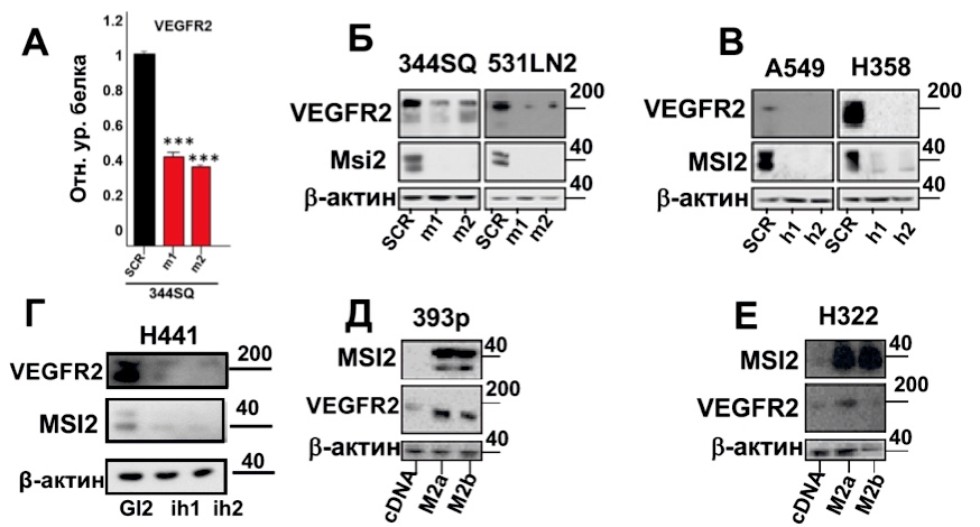
Регуляция VEGFR2 белком MSI2. A, Уровень белка VEGFR2 в мышиной клеточной линии 344SQ с кшРНКиндуцированным снижением уровней MSI2 ('m1,'m2), и в негативном контроле (SCR), оцененный с помощью метода RPPA; Б, В, Г: Вестерн блотанализ уровня VEGFR2 в мышиных и человеческих клеточных линиях НМРЛ с кшРНКиндуцированным снижением уровней MSI2 ('m1 и 'm2, 'h1 и 'h2) и негативным контролем (SCR), а также миРНКнокдауном MSI2 (ih1, ih2) и GL2 негативным контролем в H441 клеточной линии; Д, Е: Вестерн блотанализ уровня VEGFR2 в человеческой клеточной линии H322M со сверхэкспрессированным('M2a, 'M2b) MSI2 и контролем (cDNA). Полученные данные были статистически проанализированы с использованием теста Манна-Уитни*** p<0.001
| Уровень MSI2 повышен в НМРЛ. A) Денситометрия уровня белка MSI2 в 7 неинвазивных7 метастазирующихмышиных клеточных линиях НМРЛ; Б) Уровень белка MSI2 в образцах ткани пациентов (22 нормальных и 123 опухолевых), оцененный методом тканевых матриц. Полученные данные были статистически проанализированы с использованием теста Манна-Уитни; ***p< 0.001. |
Поддержано грантом РФФИ 18-44-160004
Исследование эффективности комбинированной химиотерапии рака легкого ингибиторами тирозинкиназсемейства SRC (SFK) и белков теплового шока 90
Исполнители: Денека А., Мазитова А., Топчу Ю.
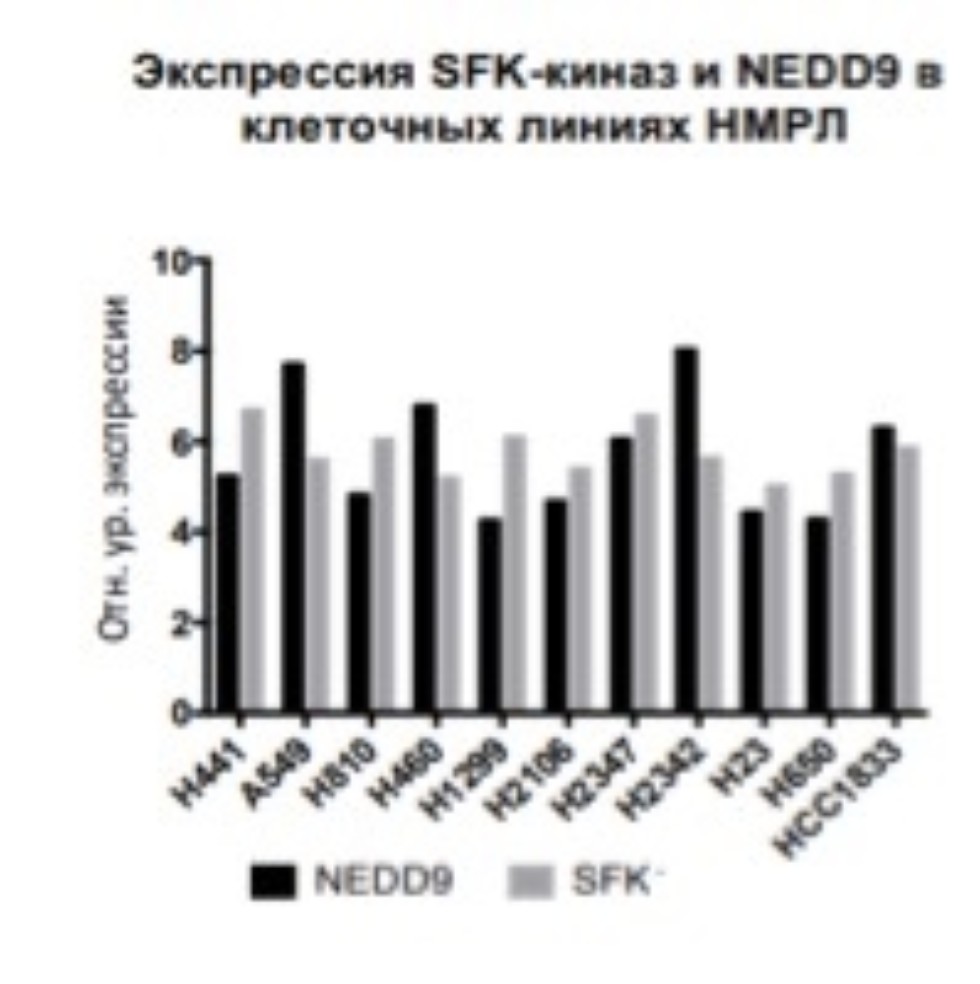
Прогрессирование, инвазия, химиотерапевтическая резистентность и усиленный ангиогенез у многих опухолей, в том числе и при раке легкого сопровождаются увеличением активности внутриклеточных сигнальных белковых путей. Одними из таких белков являются тирозинкиназы семейства SRC (SFK). Также при раке легкого, как и в других солидных опухолях, отмечается повышенная экспрессия белков теплового шока 90 (БТШ90). Поддерживающий белок NEDD9 регулирует активность SFK киназ и недавно был описан в литературе как маркер-предиктор течения и ответа на химиотерапевтическое воздействие при немелкоклеточном раке легкого (НМРЛ). |
|
В данном исследовании производится оценка эффективности двойного ингибирования - SFK и БТШ90 в контексте экспрессии NEDD9. Это позволит обнаружить и описать механизм роста и метастазирования НМРЛ за счет действия регуляторных белков, которые могут служить как мишенями таргетной химиотерапии, так и модуляторами клеточного ответа на химиотерапевтическое лечение.
Поддержано грантом РНФ 18-75-00104
Исследование роли аутофагии в агрессивности и лекарственной устойчивости эпителиального рака яичников
Исполнители: Габбасов Р., Мазитова А., Биктагирова Э., Мингазова Л.
Эпителиальный рак яичников (ЭРЯ) – наиболее опасная онкогинекологическая патология. В основе лечения лежат хирургическое удаление опухоли и лечение препаратами платины и таксанами. Несмотря на первоначальную эффективность химиотерапии, в большинстве случаев опухоли развивают устойчивость к данным препаратам. По перечисленным причинам 5-летняя выживаемость при ЭРЯ не превышает 30%. Необходимо продолжать исследование механизмов как развития и распространения ЭРЯ, так и появления у клеток опухолей яичников лекарственной устойчивости. Макроаутофагия (далее - аутофагия) наиболее известна как один из видов программируемой клеточной гибели, однако данный процесс может иметь и цитопротекторную роль. Исследование двойственной роли аутофагии в развитии резистентности к цисплатину может способствовать преодолению лекарственной устойчивости злокачественных опухолей яичников.
Цель настоящего проекта: исследовать роль аутофагии в процессе адаптирования клеток эпителиального рака яричников к цисплатину, а также предикативный потенциал экспрессии маркеров аутофагии в клинических случаях ЭРЯ. В рамках поставленной цели будут решаются следующие задачи:
- Выявление роли индуцированной химиотерапией аутофагии в выживании клеток в присутствие цисплатина и развитии лекарственной устойчивости
- Изучение ассоциации экспрессии маркеров аутофагии и апоптоза с клиническими проявлениями эпителиального рака яичников.
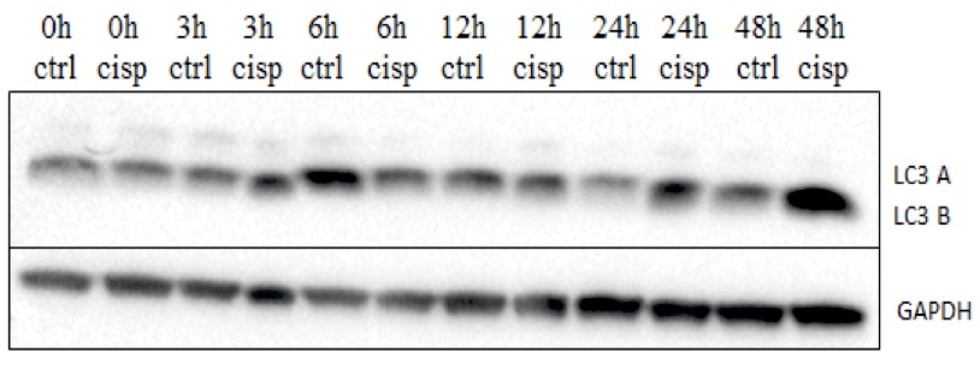
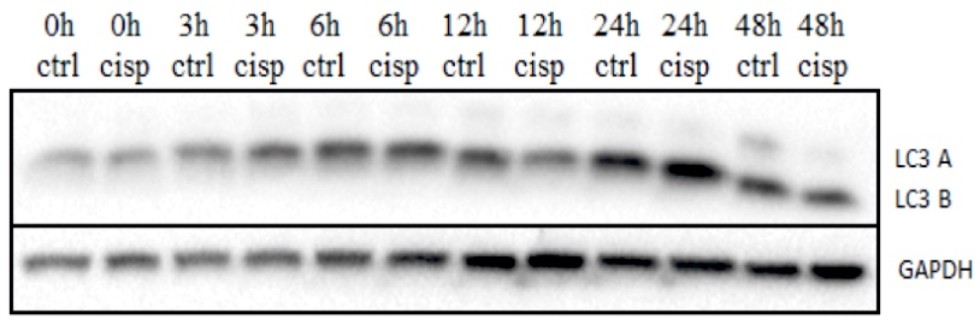
Изменение экспрессии маркера аутофагии белка LC3B в клетках CaOV-3 в течение 48 часов при наличии и отсутствии в среде цисплатина.
Изменение экспрессии маркера аутофагии белка LC3B в клетках OVCAR-8 в течение 48 часов при наличии и отсутствии в среде цисплатина |
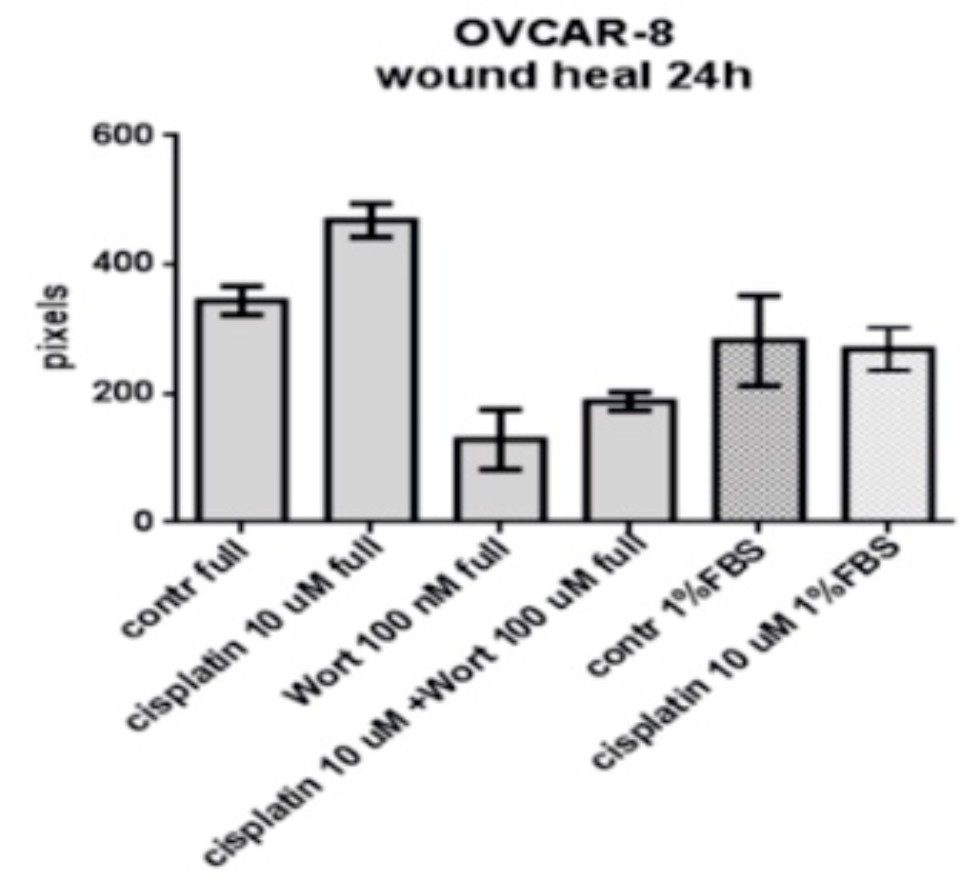
Скорость миграции клеток линии OVCAR-8 в монослое в течение 48 часов при наличии и отсутствии в среде цисплатина и ингибитора аутофагии вортманина. |
Поддержано грантом РФФИ мол-А 18-315-00317
Исследование роли аутофагии в развитии лекарственной устойчивости в клетках немелкоклеточного рака лёгкого
Исполнители: Габбасов Р., Мазитова А., Биктагирова Э., Топчу Ю.
Немелкоклеточный рак лёгкого (НМРЛ) занимает лидирующие позиции по заболеваемости и смертности среди онкологических заболеваний в России и мире. При НМРЛ цисплатин является наиболее часто используемыми химиопрепаратами I линии. Эффективность цисплатиновой химиотерапии при НМРЛ ограничивается врождённой и приобретённой устойчивостью клеток опухоли к препарату. Цисплатиновая устойчивость обуславливается большим числом молекулярных механизмов, и единого пути её преодоления не найдено. Следовательно, поиск новых механизмов регуляции циплатиновой устойчивости клеток НМРЛ является актуальной научной задачей. Описана связь между лекарственной устойчивостью многих солидных опухолей и эпителиально-мезенхимальным переходом (ЭМП). Мы предполагаем, что аутофагия является фактором, регулирующим процесс развития клетками НМРЛ цисплатиновой устойчивости через ЭМП и приобретением свойств стволовых клеток.
Исследование направлено на решение следующих фундаментальных задач:
- Определить роль аутофагии в регуляции эпителиально-мезенхимального перехода как механизма, способствующего адаптации к клеток НМРЛ к лечению цисплатином и развитию устойчивости к данному препарату;
- Изучить роль аутофагии в развитии клетками НМРЛ, устойчивыми к цисплатину, фентотипов стволовых клеток;
- Выявить влияние аутофагии на ЭМП и общую агрессивность НМРЛ на клинических образцах НМРЛ.
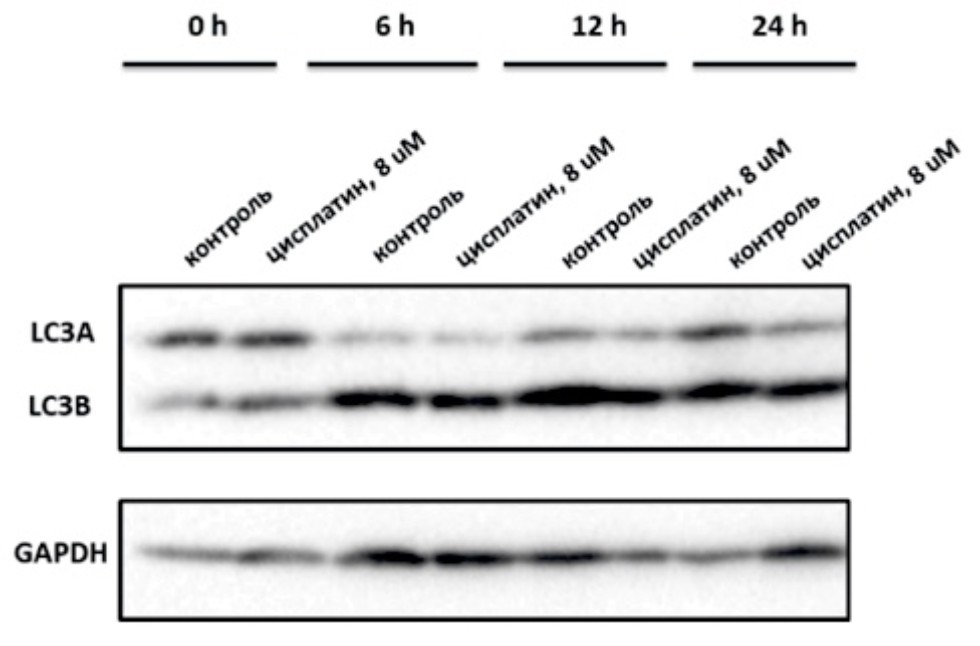
Изменение экспрессии маркера аутофагии белка LC3B в клетках А549 в течение 24 часов при наличии и отсутствии в среде цисплатина. |
Миграция клеток А549 контрольных и обработанных цисплатином (8 мкм) при моделировании раны в физиологических условиях. Слева: примеры микрофотографий клеток А549, фронт миграция ограничен пунктирной линией. Справа: данные количественного анализа миграции. |
Поддержано грантом РФФИ А 18-015-00495
Исследование ингибиторов киназ, влияющих на динамику цилии и цилия-ассоциированные сигнальные каскады
Исполнители: в.н.с., к.н. Серебрийский И.Г., профессор, д.б.н. Абрамова З.И., м.н.с. Киселева А.А.
Первичная гипотеза: цилия или первичная ресничка является клеточной структурой, проецируемой на поверхность клетки с целью передачи сигналов через рецепторы, локализованные в цилийной мембране. Согласно многочисленным исследованиям, дефекты структуры цилии и, как следствие, нарушения цилия-опосредованной передачи сигналов, играют важную роль в патогенезе раковых заболеваний и целого отдельного класса генетических расстройств – цилиопатий, к которым, в частности, относится поликистоз почек. Скрининг доклинических и клинических ингибиторов протеинкиназ на предмет их влияния на динамику цилии и цилия-ассоциированных сигнальных каскадов представляет собой эффективный подход, целью которого является выявить новые варианты терапии для лечения цилиопатий и онкологических заболеваний.
Результаты: на основании проведенного скрининга из 178 ингибиторов было выявлено, что противоопухолевый препарат сунитиниб активирует разборку цилий и эффективно контролирует течение аутосомно-доминантного поликистоза почек. Кроме того, было показано, что сунитиниб ингибирует цилия-ассоциированный сигнальный каскад SonicHedgehog.
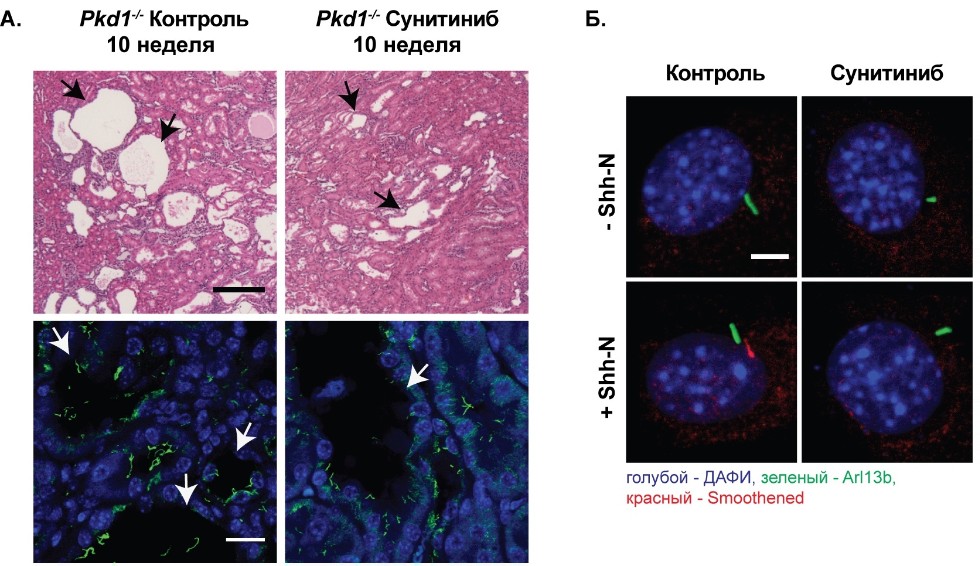
Рисунок 1. А. Репрезентативные гистологические и иммуногистохимические изображения почек мышей Pkd1 wtили Pkd1-/-, леченых контрольным раствором или сунитинибом. Данные демонстрируют значительное уменьшение числа кист и сокращение общего числа ресничек после лечения сунитинибом. Б. Репрезентативные изображения распределения рецептора Smoothenedв ресничках NIH3T3 клеток, леченных сунитинибом до и после инкубации со специфичным лигандом Hedgehog сигнального пути.
Анализ данных генетической экспрессии, полученных с помощью технологии NANOSTRING, в циркулирующих опухолевых клетках и циркулирующих молекулах мРНК
Исполнители: в.н.с., к.н. Серебрийский И.Г., в.н.с., к.м.н. Бумбер Я.А., м.н.с. Власенкова Р.А.
Актуальность: Основой диагностики раковых заболеваний является биопсия. Однако биопсия опухолевой ткани, которая является инвазивной процедурой, к сожалению, не всегда может быть выполнена. В связи с этим большое значение имеет разработка неинвазивных методов анализа онкомаркеров, с помощью которых можно отслеживать динамику опухолевого процесса в реальном времени, таких как жидкостная биопсия. На данный момент на рынке технологий для исследования жидкостной биопсии существует несколько вариантов. Одной из таких технологий является – платформа NanostringTechnologies.
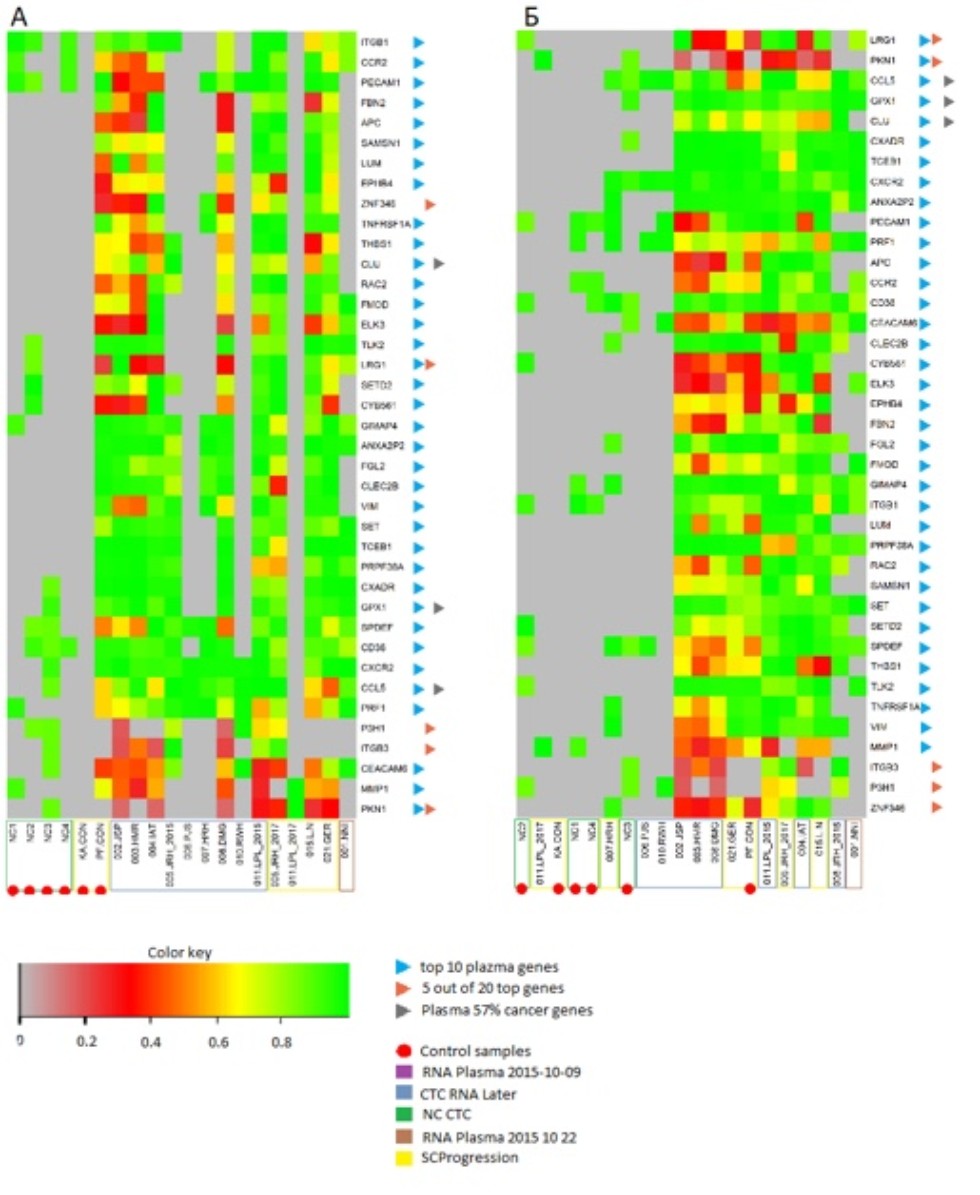
Тепловые карты экспрессии генов циркулирующих молекулах мРНК(А) и циркулирующих опухолевых клетках (Б) | Цель: изучение возможностей применения технологии Nanostringс помощью биоинформатических методов анализа Задачи: -Провести анализ воспроизводимостиданных, полученных с помощью технологии Nanostring - Провести анализ данных генетической экспрессии в циркулирующих опухолевых клетках и циркулирующих молекулах мРНК, взятых у пациентов, больных мелкоклеточным и немелкоклеточным раком легких. - Построить список генов-идентификаторов Результаты: был выработан технологический процесс анализа данных генетической экспрессии в циркулирующих опухолевых клетках и циркулирующих молекулах мРНК на примере больных мелкоклеточным и не мелкоклеточным раком легких. |
Поиск высокоселективных киназных ингибиторов
Исполнители: в.н.с., к.н. Серебрийский И.Г., м.н.с. Андрианов Г.В.
Актуальность: Киназы являются значимой частью многих жизненно важных сигнальных каскадов и часто их нарушенная активность связана возникновением различных раковых и воспалительных заболеваний. В связи с этим, многие считают, что они являются перспективными мишенями для разработки терапии. Однако текущая разработка ингибиторов для киназ имеет ряд существенных проблем:
- Новые перспективные ингибиторы часто имеют сложные схемы синтеза, которые трудно воспроизвести. В свою очередь сильно усложняет проверку соединения против других мишеней. А следовательно, "химическое пространство" текущих ингибиторов сильно ограничено.
- Консервативность АТФ-связывающего кармана является проблемой для поиска высокоселективных ингибиторов. Помимо этого, существует множество различных конформаций активных состояний киназ, что также затрудняет разработку лекарств.
Для решения этих проблем, было решено использовать in silico метод, который позволит расширить доступное ”химическое” пространство и найти высокоселективные коммерчески доступные соединениия.
Цель: Разработка высокопроизводительно метода для получения высокоселективных коммерчески доступных легкосинтезируемых ингибиторов для киназ.
Задачи:
- Поиск перспективных соединений, которые являются перспективными для дальнейшей оптимизации и которые имеют легкую схему синтеза.
- Отбор киназ, для которых будут разработаны селективные ингибиторы
- Оптимизация параметров метода
- Проверка лучших кандидатов in vitro
Результаты: В качестве исходного соединения был использован ингибитор MC180295, который имеет наномолярную активность против киназы CDK9. Основываясь на схеме синтеза этого соединения, функциональные группы были замещены на коммерчески доступные аналоги из каталогов Sigma-Aldrich и enAmine. После этого, комбинации новых функциональных групп были ранжированы по аффинности и консервативности взаимодействия коровой части MC180295 с киназным доменом. На следующем шаге все новые соединения, у которых аффинность выше, чем MC180295, были проанализированы в комплексе с CDK11A. В конечном итоге были отобраны только те соединения, у которых разница в аффиности CDK9 и CDK11A была значимой.
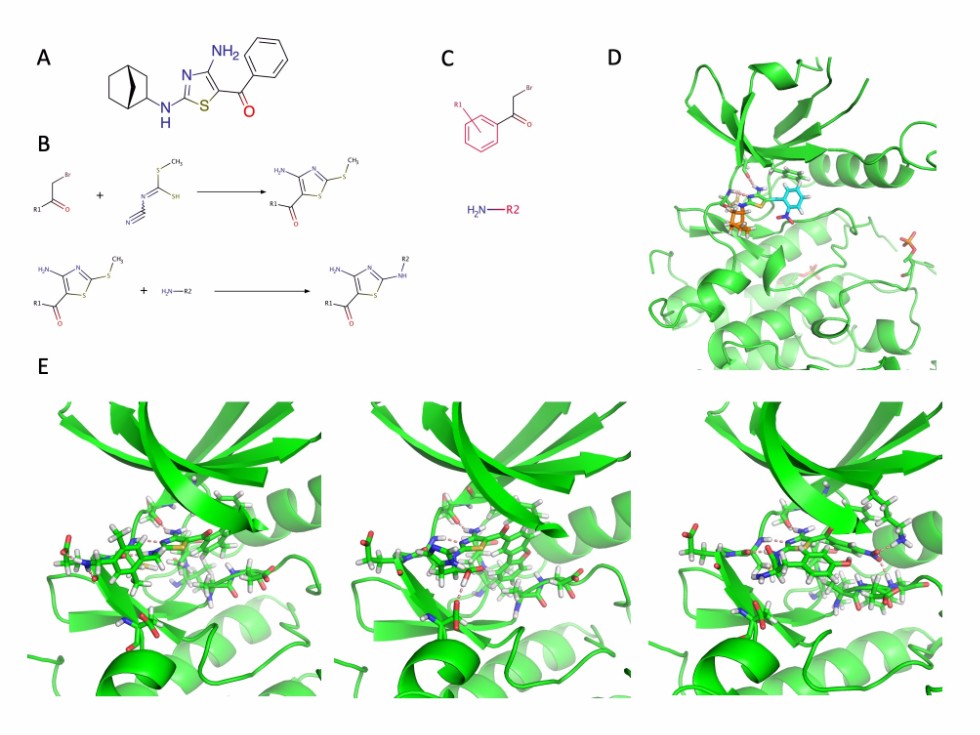
Рисунок 1. А. Структурная формула исходного ингибитора CDK9 - MC180295. B. Двухступенчатый синтез MC180295. С. Шаблоны для поиска функциональных групп в каталогах Sigma Aldring и enAmine. D. Кристаллический комплекс CDK9 и MC180295. E. Три лучших селективных ингибитора для CDK9.
Идентификация и характеристика новых молекулярных маркеров, вовлеченных в регуляцию ответа к химиотерапевтическим агентам
Исполнители: м.н.с. Абрамов С. Н. м.н.с. Шарафетдинова Л.М., с.н.с., к.б.н. Биктагирова Э.М., в.н.с., к.н. Асцатуров И.А., в.н.с., к.н. Серебрийский И.Г.
Цель проекта: Идентификация и характеристика новых молекулярных маркеров, вовлеченных в регуляцию ответа к действию химиотерапевтических агентов, которые могут быть использованы для разработки на их основе стратегий персонализированного лечения онкологических больных. Для выполнения проекта применяется комплексный подход, включающий современные методы in silico, in vitro, in vivo
Направления работы:
Работа ведется при поддержке Российского научного фонда (грант РНФ 15-15-20032) и Программы Партнерства Университетов (ППУ)