Научно-исследовательская работа кафедры

В 2011 году Казанский федеральный университет стал участником федеральной целевой программы 'Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу' (Фарма 2020). В рамках программы создан Научно образовательный центр (НОЦ) Фармацевтики. Отдел генных и клеточных технологий НОЦ возглавляет доцент кафедры генетики, д.б.н., Ph.D. А.А. Ризванов.
Отдел проводит разработку новых комбинированных методов генной и клеточной терапии различных заболеваний человека (нейродегенеративные заболевания, посттравматическая регенерация органов и тканей, ишемические заболевания, атеросклероз и др.), клеточных и молекулярных моделей скрининга и доклинических исследований лекарственных препаратов (противоопухолевых, противовирусных, нейропротекторных и др.).
Молекулярные механизмы регуляции азотного обмена в клетках грамположительных бактерий
Живая клетка постоянно находится в тесном контакте с меняющейся внешней средой и вынуждена перестраивать обмен веществ с целью минимизации энергетических затрат. Информация о метаболическом состоянии клетки передается на все клеточные процессы для поддержания пластического и энергетического гомеостаза и нормального протекания биохимических процессов. Наличие в среде легко усваиваемых питательных веществ подавляет катаболизм сложных соединений, таких как белки, нуклеиновые кислоты, полисахариды. Понимание молекулярных механизмов регуляции метаболизма клетки является фундаментальной основой для 1) создания новых и оптимизации существующих биотехнологических процессов и 2) разработки новых антибактериальных препаратов и подходов.
В данном исследовании предлагается исследование роли и молекулярных механизмов функционирования PII-подобных белков, выполняющих в клетках бактерий роль глобальных сенсоров доступности энергетического и азотного питания, у представителей двух порядков класса бацилл (Bacillales и Lactobacillales).
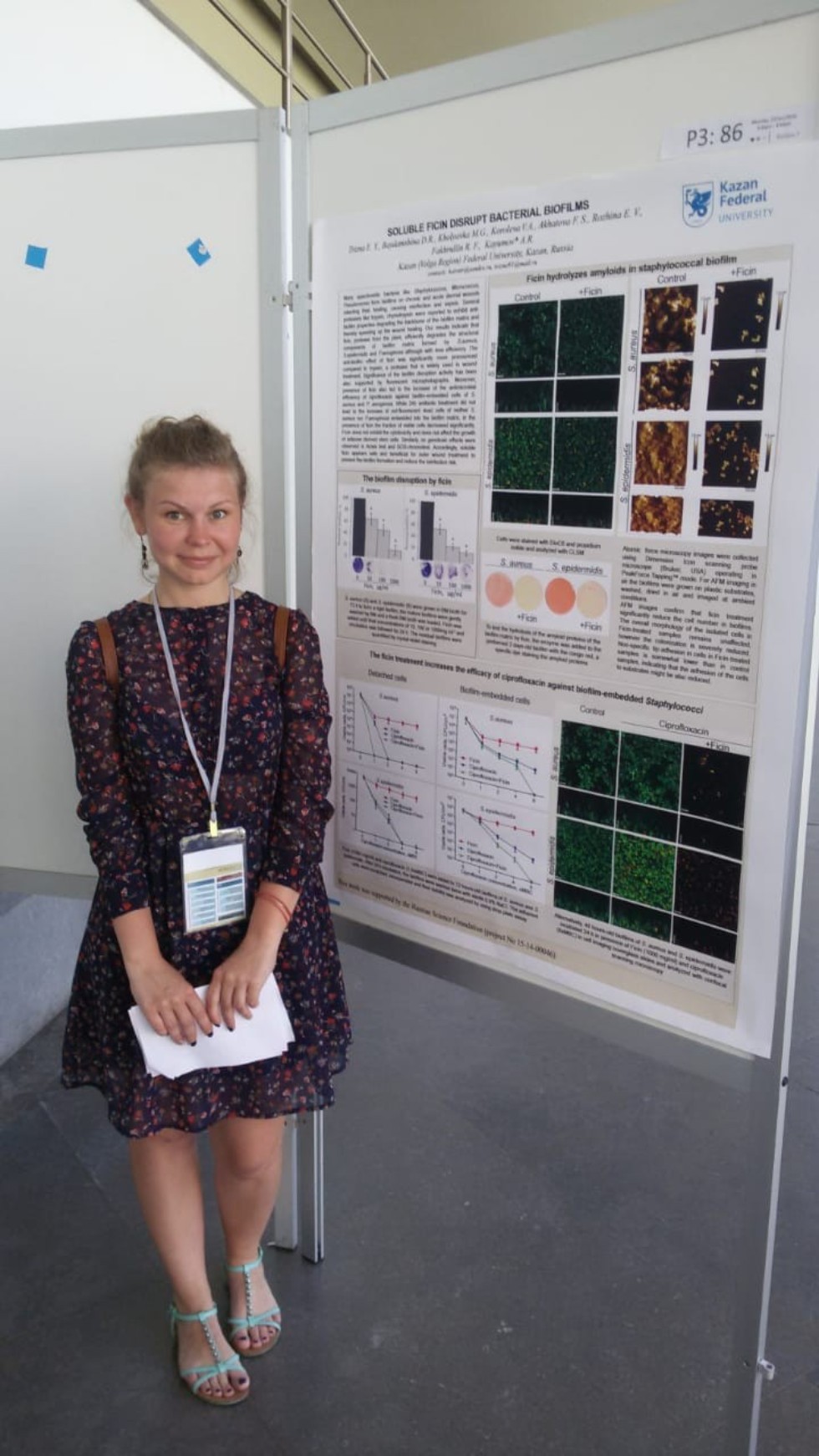
Подавляющее большинство инфекционных заболеваний человека и животных так или иначе связано с образованием биопленок – микробных консорциумов, погруженных в выделяемый ими высокомолекулярный матрикс, состоящий из белков, нуклеотидов и полисахаридов и обуславливающий чрезвычайную устойчивость бактерий к неблагоприятным факторам, включая антибиотики и иммунную систему организма. Существование патогенных бактерий в составе биопленки в разы снижает эффективность антимикробной терапии и значительно замедляет процесс заживления ран. В последнее время показано, что причиной многих инфекционных процессов является не один микроорганизм, а их консорциум, в том числе с резидентной флорой, в результате чего образуются смешанные биопленки на тканях организма и поверхностях имплантированных устройств. В смешанных биопленках между бактериями наблюдаются синергетические и мутуалистические взаимодействия, вследствие чего лечение смешанных инфекций происходит значительно сложнее и дольше. Одним из наиболее тревожных последствий синергизма между микроорганизмами является повышенная устойчивость к антимикробным агентам. Тем не менее, в литературе на сегодняшний день практически отсутствуют данные о характере и механизмах взаимодействия многих бактерий в составе смешанных биопленок, которые достаточно часто образуются на слизистых оболочках. Данные об эффективности антибиотиков для эрадикации таких биопленок также отсутствуют. В ходе реализации данного проекта будут 1) установлены закономерности взаимодействия между различными видами микроорганизмов в составе смешанных биопленок;
2) оценена эффективность различных групп антибиотиков для терапии таких консорциумов;
3) установлена существования одних бактерий в матриксе биопленки другого вида в условиях антибиотикотерапии и степень повышения их устойчивости к препаратам;
4) установлены фенотипические и молекулярные механизмы изменения чувствительности бактерий к антибиотикам при терапии смешанных инфекций;
5) на основе полученных данных будут предложены подходы к разработке методов повышения эффективности антибиотиков в отношении смешанных инфекций,
6) оценена возможность повышения эффективности антимикробной терапии путем интервенции сапрофитной микрофлоры или внесения микробных секретов в очаг воспаления. Владение данной информацией позволит скорректировать рекомендации по рациональному использованию различных групп антибиотиков в зависимости от микробного состава инфекции и повысить эффективность ее терапии.
Разработка новых биотехнологически ценных штаммов лактобацилл
Цель проекта - скрининг биотехнологически важных свойств у новых штаммовлактобацилл, выделенных из кисломолочных продуктов, растительного материала и желудочно-кишечного тракта человека.
Бактерии рода Lactobacillus в силу своих биологических особенностей чрезвычайно перспективны в фокусе научного и биотехнологического интереса. Они представляют собой важный компонент естественной микрофлоры кишечного и урогенитального трактов человека и животных, поэтому интенсивно используются в производстве пробиотических препаратов и продуктов функционально питания (йогуртов, бактериальных заквасок и т.п.). Также они широко применяются в пищевой промышленности, поскольку определяют направленность биотехнологических процессов в производстве многих кисломолочных продуктов. Селекция новых производственно перспективных штаммов лактобацилл – важная и актуальная задача, поскольку влечет за собой увеличение разнообразия биотехнологической продукции.
Бактерии рода Lactobacillus, входящие в облигатную флору кишечника и слизистых оболочек человека, образуют многочисленные антимикробные пептиды - бактериоцины. Бактериоцины лактобацилл способны влиять на синтез пептидогликана, дестабилизировать цитоплазматические мембраны и образовывать в них поры, тем самым значительно повышая эффективность антибиотикотерапии, и позволяя значительно снизить дозу антибиотика. Поэтому использование подобных пептидов представляет интерес в качестве инструмента борьбы с инфекциями и повышения эффективности антибиотикотерапии штаммов с множественной устойчивостью. В проекте предлагается провести скрининг новых природных бактериальных пептидов бактерий рода Lactobacillus, изолированных из различных природных источников - ферментированных пищевых продуктов и растительного сырья, кисломолочных продуктов, желудочно-кишечного тракта человека.
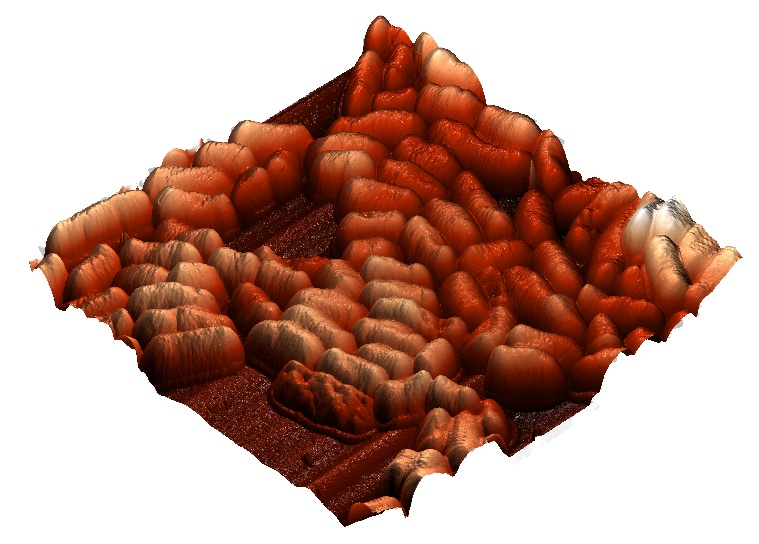
В настоящее время микроскопия является одним из ключе
вых инструментов бактериологических и гистологических исследований. Автоматизированный анализ данных световой, флуоресцентной и электронной микроскопии направлен как на повышение объективности исследований, так и на сокращение нагрузки на высококвалифицированный лабораторный персонал. В последние полтора-два десятилетия интенсивное развитие методов автоматизированной обработки изображений привело к появлению целого ряда прикладных алгоритмических решений для анализа микроскопических изображений и реализации прикладных программных продуктов на их основе.
Однако наиболее универсальные среди предложенных решений имеют ряд недостатков, ограничивающих возможности их использования, а альтернативные решения, как правило, носят узкоспециализированный характер. В результате в настоящее время достаточно большой объем микроскопических данных продолжает обрабатываться
вручную, либо оценка данных микроскопии сводится к эмпирическому восприятию ее результатов.
Многофункциональные инструменты должны иметь хорошо структурированное меню и интуитивно понятный графический интерфейс пользователя. Разрабатываемое программное обеспечение не привязано к другим программным пакетам и является отдельным самостоятельным приложением. Данный факт является конкурентным преимуществом, т.к. для запуска не требует никаких дополнительных приложений.
Разработанное программное обеспечение позволит автоматизировать научные исследования, а также лабораторные клинические анализы, требующие количественной оценки фракций клеток на мкрофотографиях по цвету, размеру и форме (например, гистологические срезы, препараты крови). Одновременно с автоматизацией будет повышена достоверность и снижены временные и стоимостные издержки проведения испытаний.
Создание диагностической панели для оценки качественного и количественного состава микробиоты содержимого кишечника у пациентов с H.pylori-ассоциированными заболеваниями на фоне проведения эрадикационной терапии.
- Просеквенировано более 200 образцов микробиоты кишечника
- Выявлены маркеры, обнаруживающие количественные изменения у пациентов до и после терапии
- Проведена валидация диагностической панели с использованием RT-PCR
- Создано программное обеспечение для анализа данных, полученных с помощью диагностической панели

Анализ экзомов этнических групп, проживающих на территории России, для определения особенностей генофонда татар в связи с их происхождением
с целью улучшения существующих диагностических алгоритмов и оптимизации лекарствен
ной терапии.
- Просеквенировано более 160 образцов экзомной ДНК
- В анализируемые выборки образцов вошли казанские татары, мишари, мордва (мокша и эрзя), башкиры, чуваши, карелы, буряты, нанайцы, удмурты и другие популяции Российской Федерации.
Исследования лаборатории «Генные и клеточные технологии» ведутся по нескольким основным направлениям:
- разработка методов генной и клеточной терапии для регенеративной медицины;
- исследование гуморального и клеточного иммунитета при вирусных инфекциях, аутоиммунных и инфекционных заболеваниях;
- исследования в области онкологии;
- разработка новых лекарственных препаратов на основе системы "мишень-лиганд";
- CAR-T клеточная иммунотерапия.